CRA备案及监查
发布时间:2025.01.03
来源部门:药物临床试验机构
一. 新CRA备案
1、立项时:在立项资料相应位置上传以下资料:
(1)CRA派遣函或委托书(需公司盖章);
(2)CRA简历(模版详见附件1,可接受公司模版,需体现工作经验);
(3)GCP培训证书;
(4)身份证复印件。
2、立项后:更换或新增CRA(请至少提前2周):
(1)由旧CRA或CRC将新CRA以上4类资质文件在CTMS备案;
(2)按CTMS指引将新CRA维护至项目下;
(3)将新CRA拉入项目群;
(4)扫码登记。
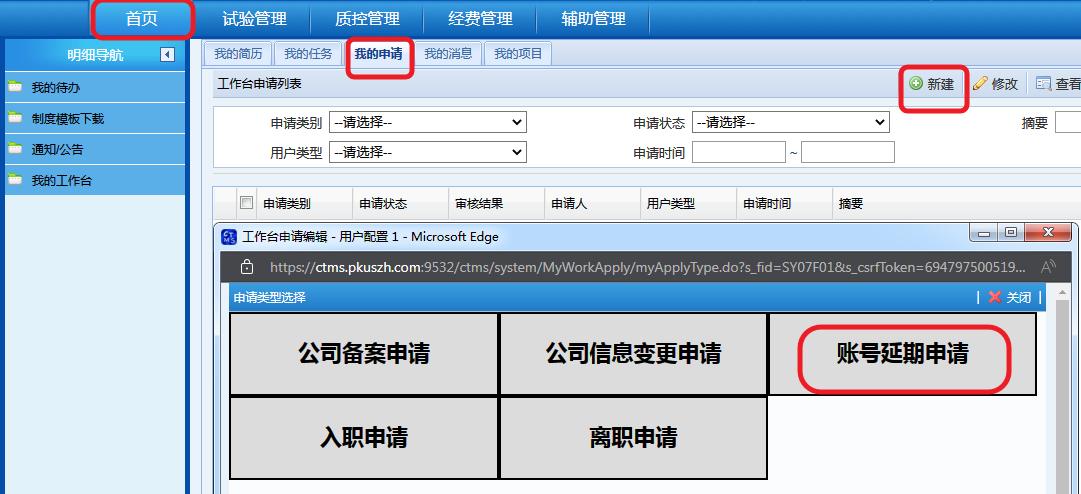
(5)开通CTMS账号后,CRA请定期登录,并按需进行账号延期申请(路径见下图)。
二 . CRA报告监查情况
(1)CRA根据本中心的监查计划、监查频率进行监查;
(2)每次监查后,并在每次机构质控前请及时在CTMS备案相关研究者及PI签字确认的《监查报告及研究者反馈表》(模版详见附件2)。